Wangslijmvliescellen
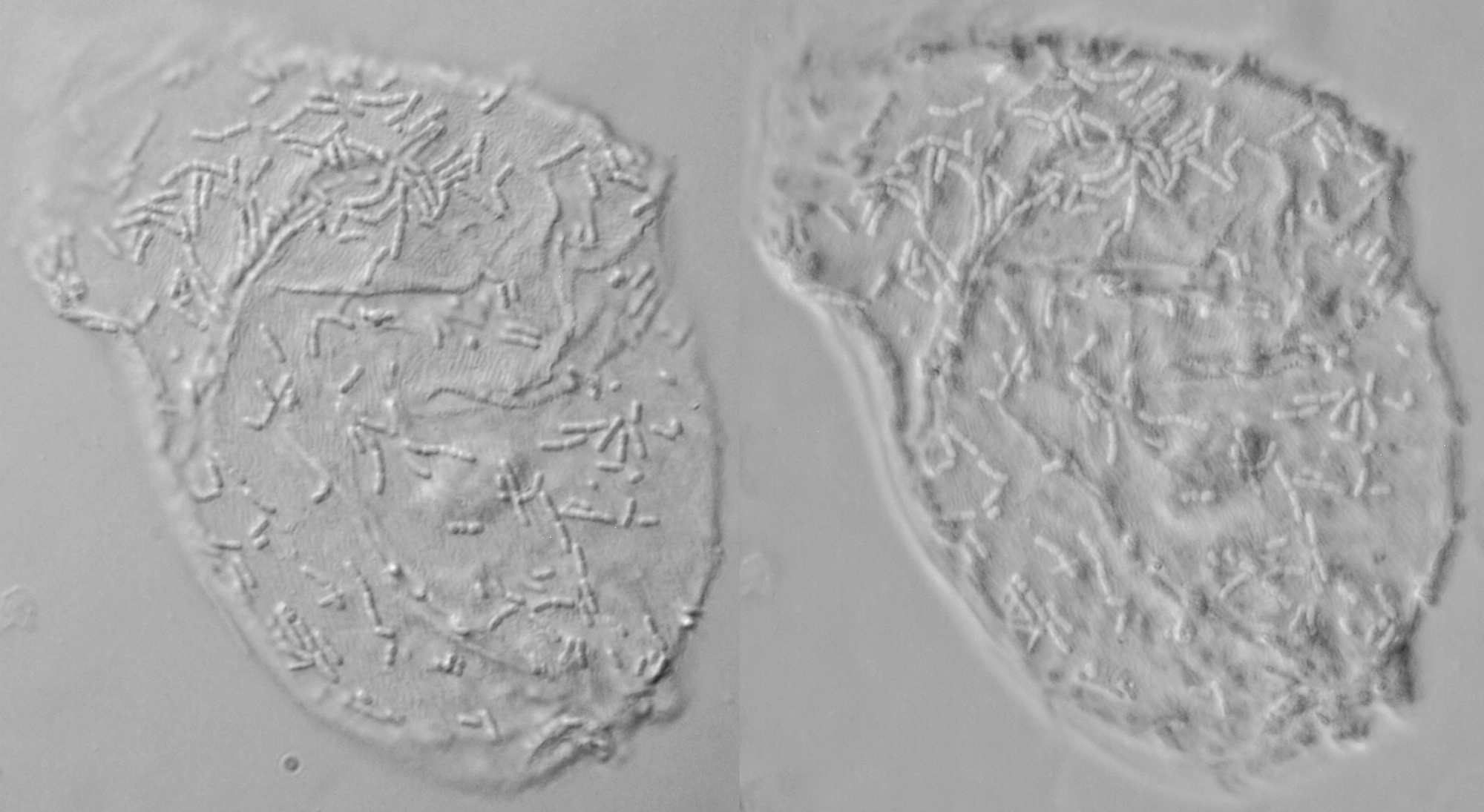
De binnenkant van de mondholte is bekleed met een laag plaveiselepitheelcellen. Dit zijn vrij grote, platte cellen die voortdurend door het wangslijmvlies worden aangemaakt en afgestoten. Het is vrij gemakkelijk om deze cellen microscopisch te bekijken. Om materiaal te bemachtigen wordt met een tandenstoker langs de binnenkant van de wang geschraapt. Vervolgens wordt het materiaal gesuspendeerd in een kleine druppel water op een objectglas. Dit wordt tenslotte met een dekglaasje afgedekt. Een ongeoefend oog zal enige moeite hebben de epitheelcellen te zien; ze zijn namelijk volledig kleurloos en transparant. Het dichtdraaien van het iris-diafragma kan helpen bij de observatie omdat hiermee het contrast wordt verhoogd maar er moet worden opgepast dat er niet te veel oplossend vermogen verloren gaat. Met een 10x objectief zijn de cellen al redelijk goed zichtbaar maar om meer details te zien hebben we een objectief 25, 40, of meer nodig. In normaal helderveld belichting zien we grote cellen met een duidelijke zichtbare celkern of nucleus in het midden van de cel en regelmatig zijn er kleinere zogenaamde micronuclei te zien. Micronuclei bestaan uit afzondelijke chromosomen of fragmenten hiervan en het geeft aan dat er schade is opgetreden. Verder bevatten de cellen veel korrelig materiaal bestaande uit keratohyaline.
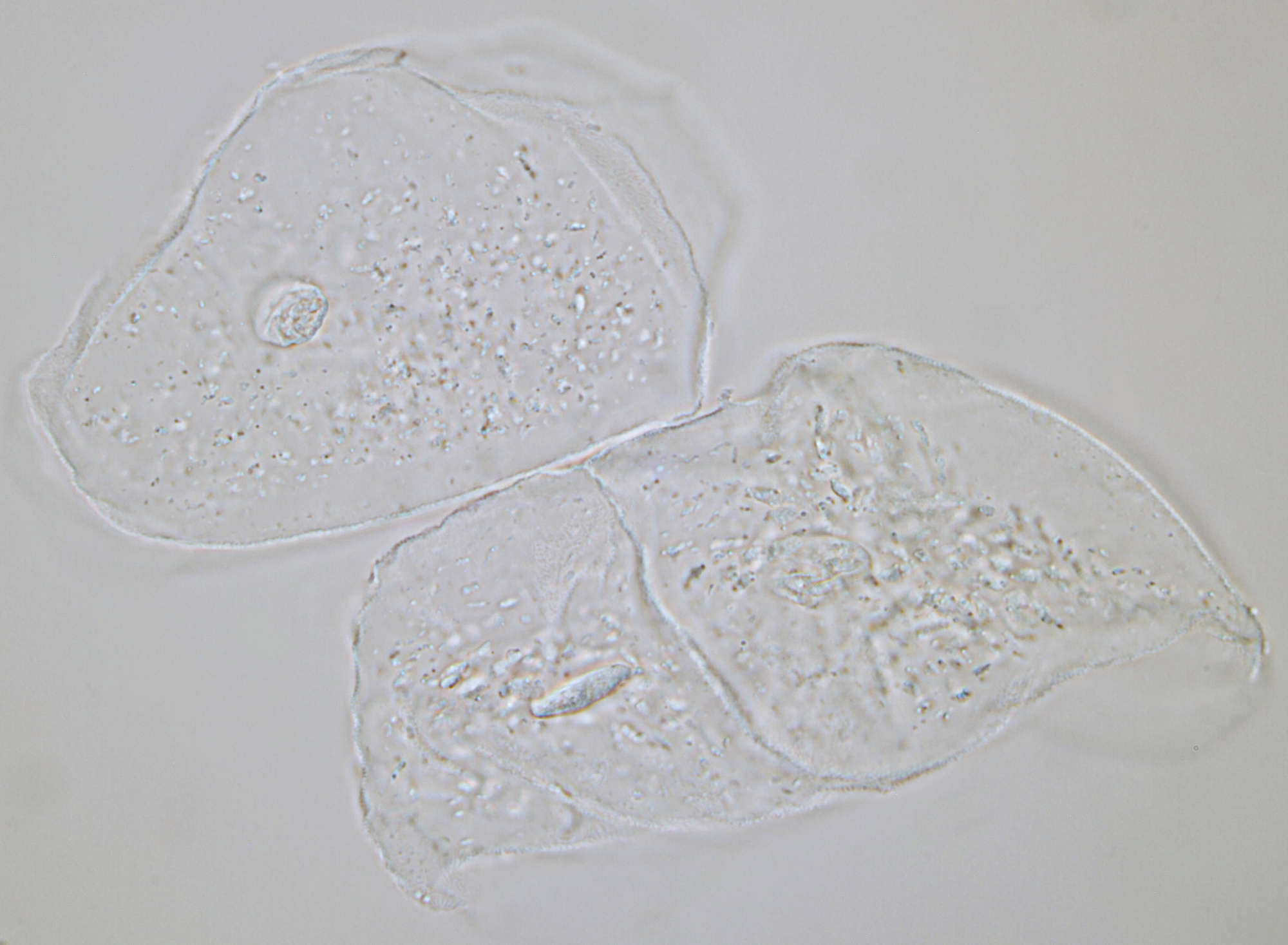
Wangepitheelcellen uit wangslijmvlies met normale helderveld belichting gefotografeerd. Zelfs zonder contrastverhogende methodes zijn er genoeg details te zien waaronder de kern in het midden van de cel. Objectief: Carl Zeiss Neofluar 63/1.25.
Om de details in wang-epitheelcellen nog beter zichtbaar te maken kan gebruikt worden gemaakt van speciale belichtingstechnieken zoals fasecontrast, donkerveld- en ringvormige of schuine belichting. Deze technieken komen ook aan de orde in de techniek sectie. Een andere manier om transparante objecten beter zichtbaar te maken is met behulp van een kleurstof waarbij de cellen aangekleurd worden met bijvoorbeeld methyleenblauw. Ik heb methyleenblauw ooit een keer in huis gehad maar dat was van korte duur. Als je er per ongeluk iets van knoeit heb je vlekken die bijna niet meer te verwijderen zijn. In het algemeen heb ik een sterke voorkeur om het contrast te verhogen met optische middelen.
Wangepitheelcellen gefotografeerd met schuine belichting. Objectief: Leitz NPL Fluotar 25/0.55.
Epitheelcellen zichtbaar gemaakt met ringvormige belichting. Deze techniek werkt contrastverhogend en geeft een ruimtelijke indruk van het object. Objectief: Leitz Pl Apo 25/0.65.
Met bijna iedere microscoop is het mogelijk om donkerveld-belichting te realiseren en deze techniek is uitermate geschikt voor het zichtbaar maken van kleurloze transparante objecten. Met donkerveld-belichting wordt door de kegelvormige verlichting het object onder een hoek aangestraald en vervolgens wordt het licht door het object gereflecteerd. Het resultaat is een zwarte achtergrond met oplichtende cellen.
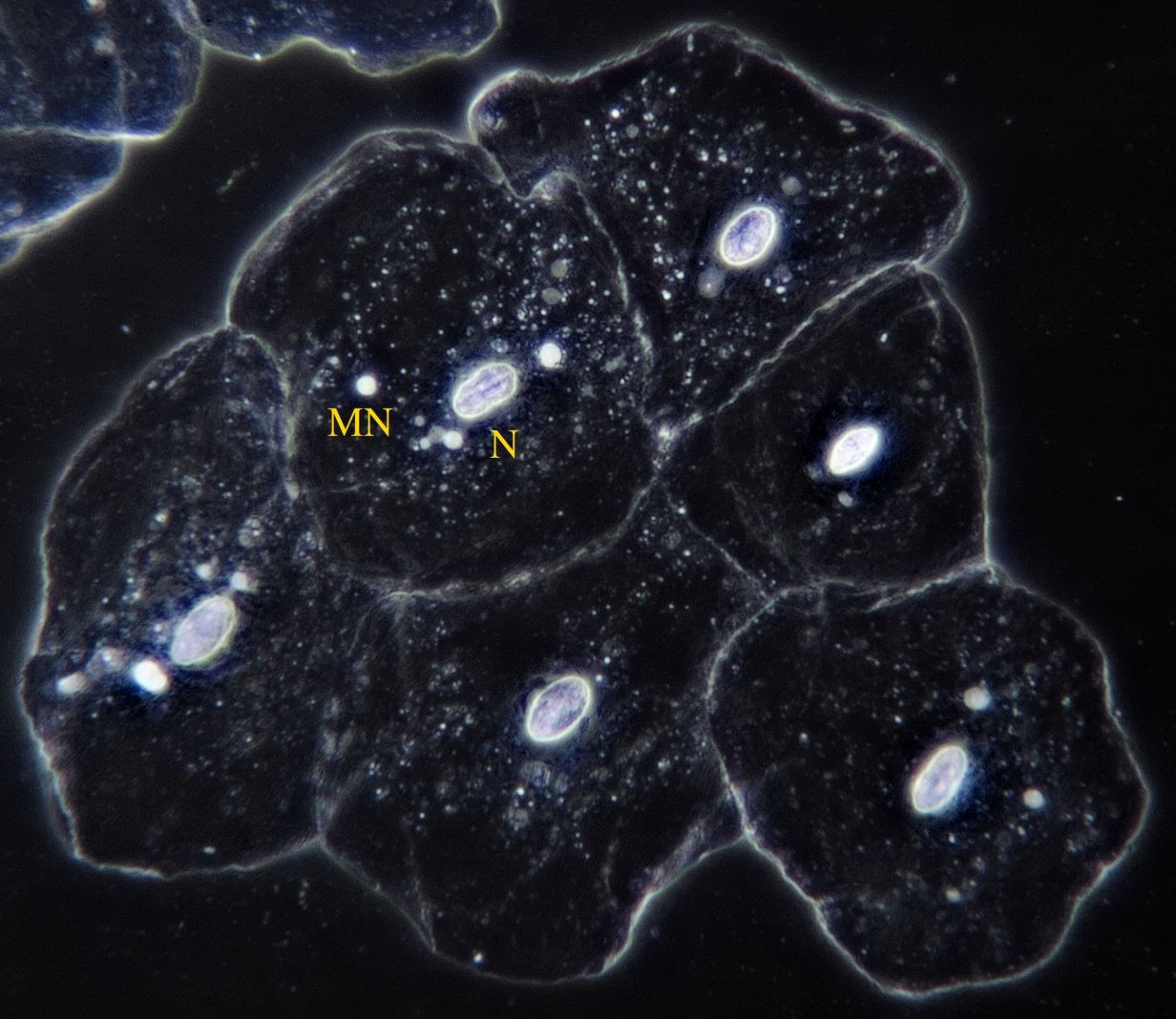
Donkerveldbelichting waardoor de nucleus (N) en de kleinere micronuclei (MN) zeer goed zichtbaar worden. In deze opname is mooi te zien hoe de cellen in hun oorspronkelijke weefselverband liggen. Objectief: Leitz 25/0.50.
En dan is er nog de fasecontrast techniek, een techniek die eigenlijk nog het meest geschikt is voor dit soort preparaten doordat alle details zeer goed worden weergegeven.
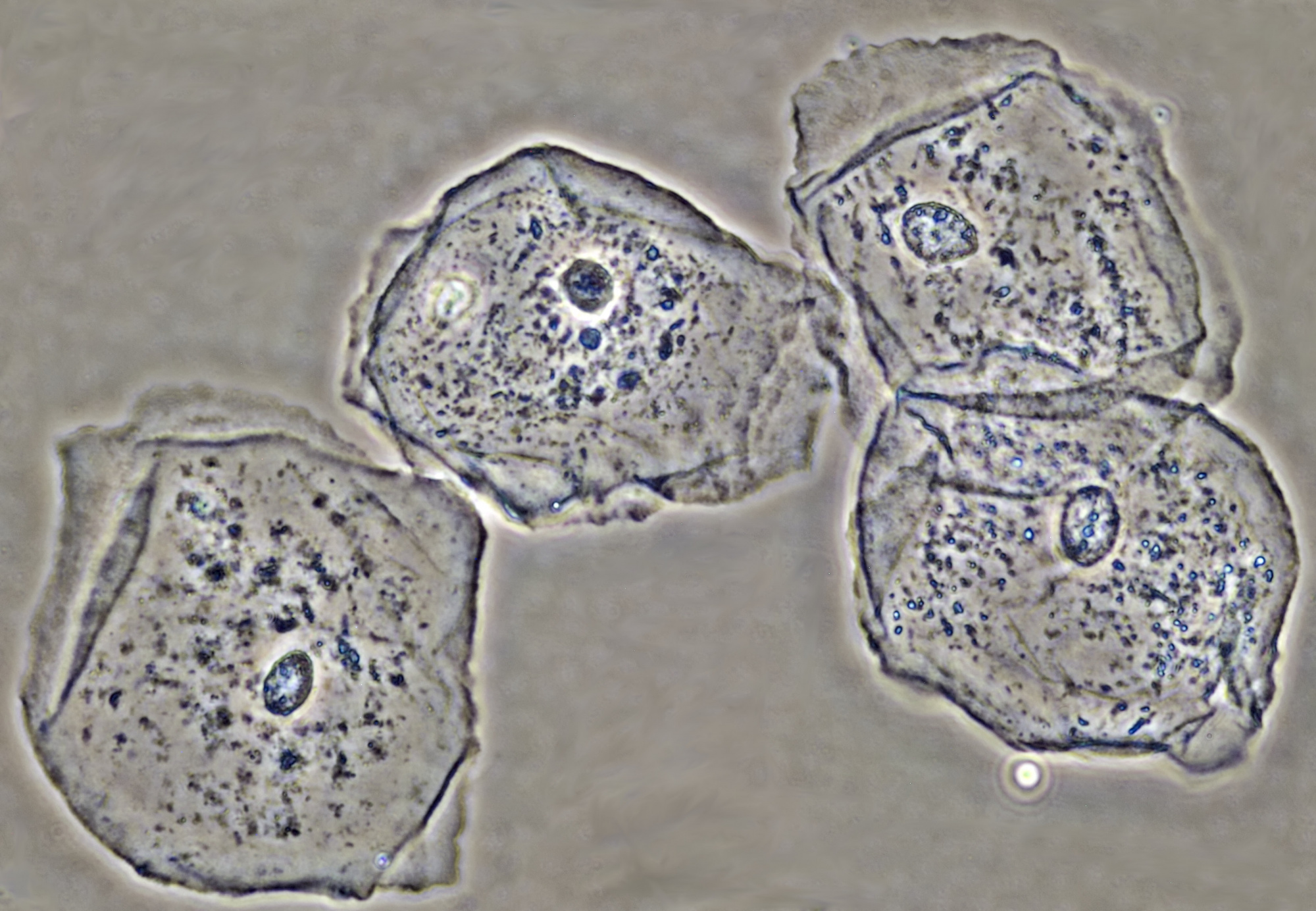
Epitheelcellen gefotografeerd in fasecontrast. Objectief: Leitz EF 40/0.65 PHACO 2.
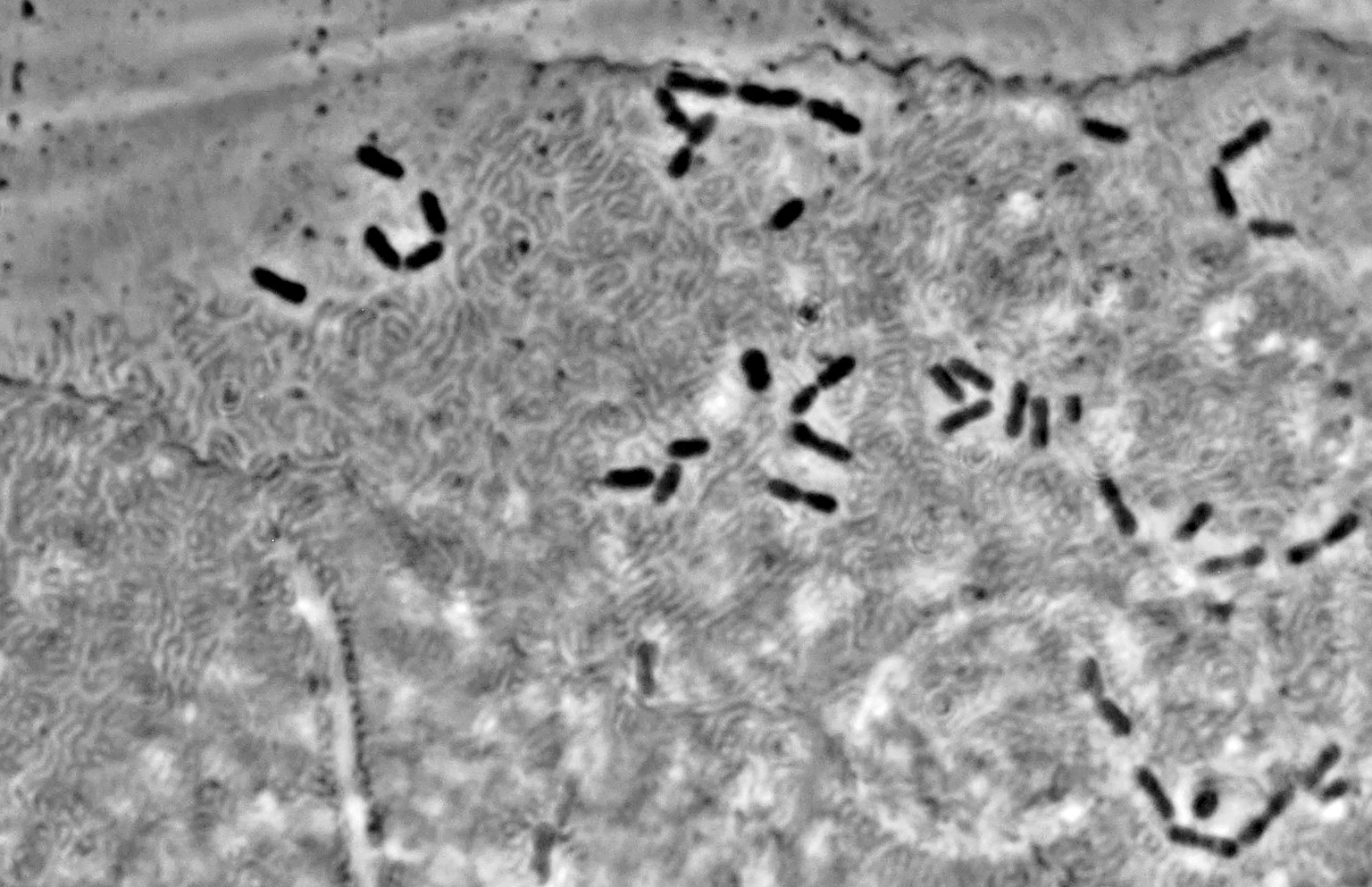
Soms zie je zeer veel bacteriën op een epitheelcel liggen. Onderstaande afbeelding geeft een goede indruk van de grootte-verhoudingen tussen epitheelcellen en bacteriën.
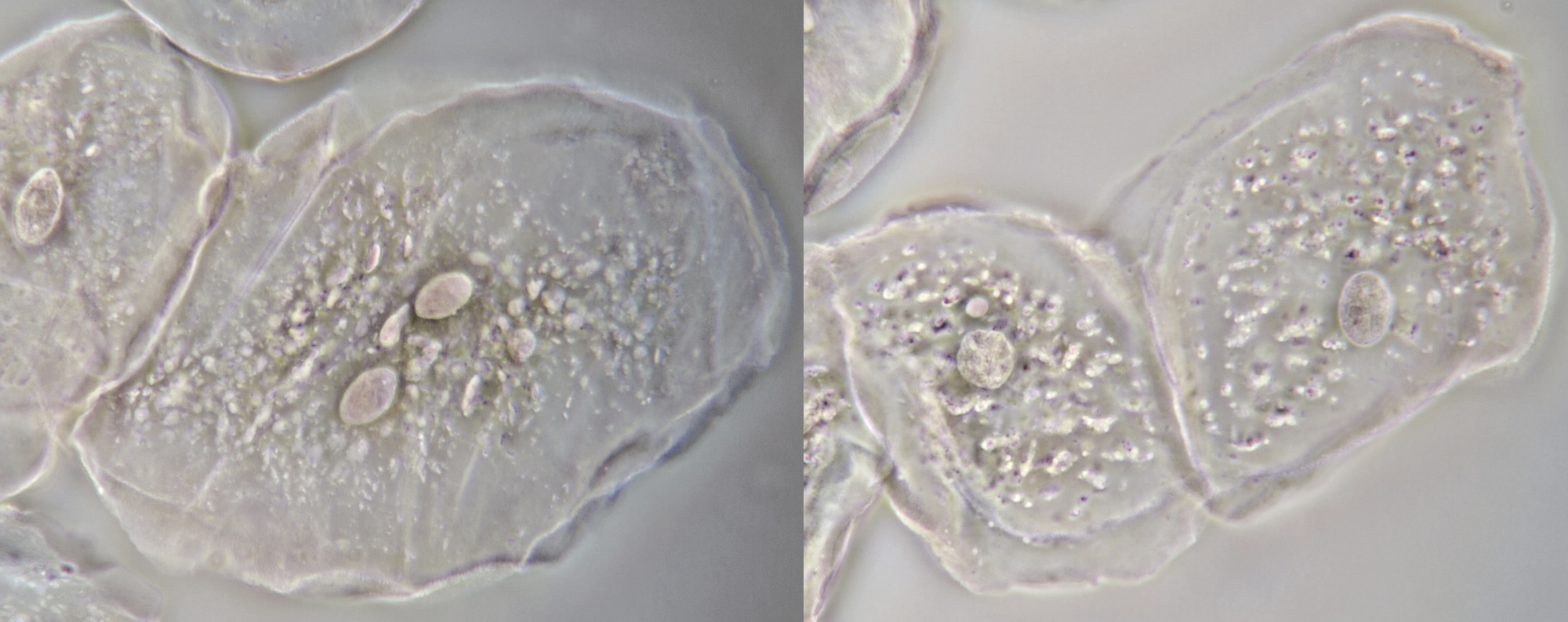
Bacteriën op een epitheelcel gefotografeerd met schuine belichting (links) en ringvormige belichting (rechts). Objectief: Leitz NPL Fluotar 40/0.70.
Gedeelte van een wang-epitheelcel gefotografeerd in fasecontrast. Naast een aantal bacteriën is hier ook de oppervlakte-structuur van de cel zichtbaar. In het begin dacht ik dat deze patronen afkomstig waren van endoplasmatisch reticulum, waar het dan ook erg veel op lijkt. Rechtsonder zijn de contouren van de celkern zichtbaar. Objectief: Zeiss Neofluar 100/1.30 Ph3.
Speeksel
Wie zijn eigen speeksel door de microscoop bekijkt komt er achter dat daar nogal wat in leeft. Met name bacteriën. Ze werden in de 17e eeuw al waargenomen door Antoni van Leeuwenhoek die een zeer eenvoudige microscoop gebruikte die slechts een enkele lens bevatte en waarmee een vergroting van 250x behaald kon worden. De orale flora bestaat voor een groot deel uit streptococcen, kleine bolvormige bacteriën die in ketens gerangschikt zijn. Deze zijn met de microscoop wat moeilijker te zien doordat ze zo klein zijn en nauwelijks verschillen van allerlei kleine verontreinigingen in het speeksel. Wel goed waar te nemen zijn de grotere staafvormige bacillen en beweeglijke bacteriën waaronder ook sommige spiraalvormige spirillen.
Om bacteriën te ontdekken in speeksel heb je een redelijk geoefend oog nodig. Om de zichtbaarheid van bacteriën in het preparaat te verhogen kan een techniek als donkerveld of fasecontrast worden ingezet. Met fasecontrast zijn bacteriën als zwarte vormen zichtbaar zoals in de volgende video te zien is.
Video van bacteriën in speeksel. Op de voorgrond links is een grote filamenteuze bacterie te zien. Aan de rechterkant is een kronkelende spiril zichtbaar. Op de achtergrond vele kleine beweeglijke bacteriën. Fasecontrast opname. Objectief: Leitz Phaco 40/0.65.
Naast bacteriën en epitheelcellen kunnen er ook nog leucocyten in speeksel voorkomen. Bij ontstekingsprocessen zal het aantal leucocyten in speeksel waarschijnlijk toenemen. Vaak zijn dode leucocyten te zien waarin zich kleine korreltjes bewegen. Dit proces is echter passief en wordt toegeschreven aan de zogenaamde brownse beweging.
Een leucocyt met Brownse beweging van de celinhoud. Fasecontrast opname. Objectief: Carl Zeiss Neofluar 40/0.75 Ph 2.
Literatuur
Jyoti S, Khan S, Afzal M, Siddique YH. Micronucleus investigation in human buccal epithelial cells of gutkha users. Adv Biomed Res 2012;1:35.
Susmita Dutta & Min Bahadur (2016) Cytogenetic analysis of micronuclei and cell death parameters in epithelial cells of pesticide exposed tea garden workers, Toxicology Mechanisms and Methods, 26:8, 627-634, DOI: 10.1080/15376516.2016.1230917
Nefić, Hilada & Mušanović, Jasmin & Kurteshi, Kemajl & Prutina, Enida & Turcalo, Elvira. (2013). The effects of sex, age and cigarette smoking on micronucleus and degenerative nuclear alteration frequencies in human buccal cells of healthy Bosnian subjects. Journal of Health Sciences. 3. 196. 10.17532/jhsci.2013.107.